질산 구리(II)
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
질산 구리(II)는 화학식 Cu(NO₃)₂를 갖는 구리의 질산염으로, 무수물과 수화물 형태로 존재한다. 무수 질산 구리(II)는 푸른색의 휘발성 고체이며, 기체 상태에서는 평면 사각형 구조를, 고체 상태에서는 3차원 배위 고분자 네트워크 구조를 갖는다. 수화 질산 구리(II)는 정팔면체 구조를 가지며, 다양한 수화물 형태가 보고되었다. 질산 구리(II)는 구리 금속과 질산의 반응, 또는 금속 구리와 질산은 수용액의 반응으로 합성될 수 있으며, 유기 화학 촉매, 금속 연마, 불꽃놀이, 볼타 전지 실험 등에 사용된다. 또한, 유기 합성에 사용되며, 구리 전해 채취에도 활용된다.
더 읽어볼만한 페이지
- 구리(II) 화합물 - 녹청
녹청은 구리나 구리 합금 표면에 자연적으로 생기는 청록색 막으로, 아세트산구리를 주성분으로 하는 다양한 구리 염 혼합물이며, 안료나 구리 부식 방지 피막으로 사용되고, 과거 독성 오해와 달리 실제 독성은 미미하다. - 구리(II) 화합물 - BSCCO
비스무트계 고온 초전도체(BSCCO)는 비스무트, 스트론튬, 칼슘, 구리, 산소로 구성된 물질로, 다양한 조성비를 가지며 110 K 이상의 높은 임계온도를 나타내는 상을 형성하고, 초전도선 제작에 사용되는 등 여러 분야에서 응용 가능성을 보인다. - 질산염 - 질산 나트륨
질산 나트륨은 화학식 NaNO3의 무기 화합물로, 비료, 산화제, 폭약 성분 등으로 사용되며, 조해성이 있고 물에 잘 녹으며, 식품 첨가물로 사용될 경우 발암성 물질 생성과 관련될 수 있다. - 질산염 - 질산 암모늄
질산 암모늄은 질산과 암모니아의 반응으로 만들어지는 염으로, 질소 비료와 폭약의 재료로 사용되며, 물에 용해될 때 흡열 반응을 일으키는 특성이 있지만 가열되거나 특정 조건에서는 폭발할 수 있어 안전 관리가 중요하다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 라우토카
라우토카는 피지 비치레부섬 서부에 위치한 피지에서 두 번째로 큰 도시이자 서부 지방의 행정 중심지로, 사탕수수 산업이 발달하여 "설탕 도시"로 알려져 있으며, 인도에서 온 계약 노동자들의 거주와 미 해군 기지 건설의 역사를 가지고 있고, 피지 산업 생산의 상당 부분을 담당하는 주요 기관들이 위치해 있다. - 표시 이름과 문서 제목이 같은 위키공용분류 - 코코넛
코코넛은 코코넛 야자나무의 열매로 식용 및 유지로 사용되며, 조리되지 않은 과육은 100g당 354kcal의 열량을 내는 다양한 영양 성분으로 구성되어 있고, 코코넛 파우더의 식이섬유는 대부분 불용성 식이섬유인 셀룰로오스이며, 태국 일부 지역에서는 코코넛 수확에 훈련된 원숭이를 이용하는 동물 학대 문제가 있다.
2. 구조와 성질
무수 질산 구리(II)와 수화 질산 구리(II)는 결정수 유무에 따라 구조와 성질이 달라진다. 무수 질산 구리(II)는 배위 고분자 네트워크 구조를 가지며, 기체 상태에서는 산소 원자 4개에 둘러싸인 평면 사각형 구조를 가진다. 수화 질산 구리(II)는 수용액에서 아쿠아 착물 [Cu(H2O)6]2+ 형태로 존재하며, 가열하면 산화 구리(II)를 생성한다.[4]
2. 1. 무수 질산 구리(II)
무수 질산 구리(II)는 몇 안 되는 무수 전이 금속 질산염 중 하나이다.[6] 물을 포함하거나 생성하는 반응으로는 제조할 수 없다. 대신, 무수 질산 구리(II)는 구리 금속을 사산화이질소로 처리할 때 형성된다.[4]:Cu + 2 N2O4 -> Cu(NO3)2 + 2 NO영어
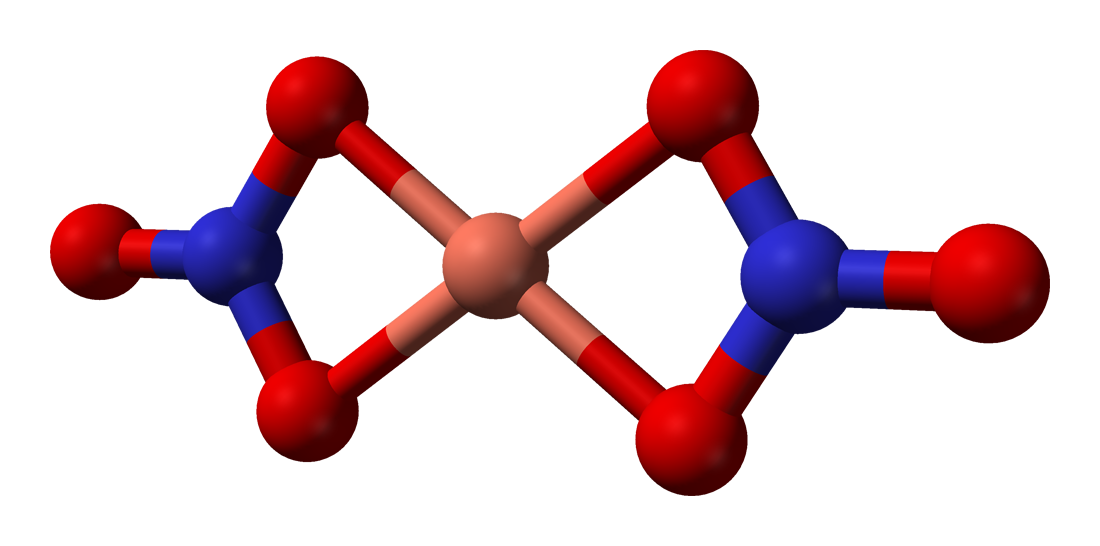
무수 질산 구리(II)에는 α와 β 두 가지 다형체가 알려져 있다.[4] 두 다형체는 모두 구리(II) 중심과 질산염 그룹의 무한 사슬을 가진 3차원 배위 고분자 네트워크이다. α 형태는 [4+1] 배위 환경을 갖는 구리 환경이 하나뿐이지만,[7] β 형태는 두 개의 다른 구리 중심을 가지며, 하나는 [4+1]이고 다른 하나는 사각 평면이다.[8]
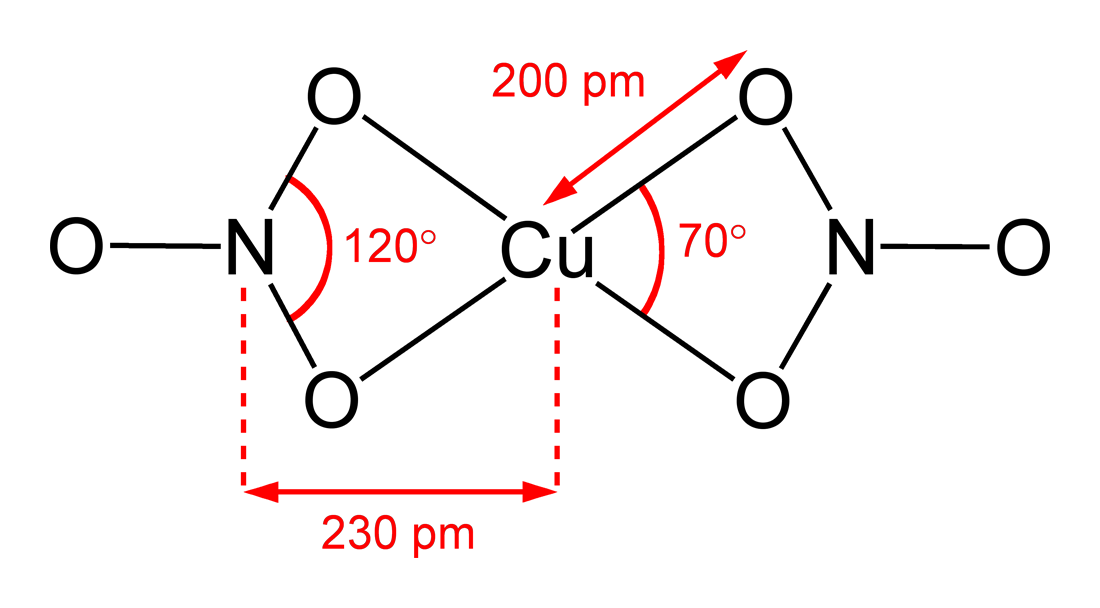
니트로메탄 용매화물 역시 "4+1 배위"를 특징으로 하며, 약 200pm의 짧은 Cu-O 결합 4개와 240pm의 더 긴 결합 1개가 있다.[9]
진공 상태에서 고체 무수 질산 구리(II)를 150°C에서 200°C로 가열하면 승화되어 단량체 질산 구리(II) 분자 기체를 생성하는 "크래킹"이 일어난다.[4][10] 기체 상태에서 분자는 두 개의 이배위 질산염 리간드를 특징으로 한다.[11]
선명한 푸른색을 띠는 휘발성 고체로, 진공에서는 승화한다. 기체 상태에서는 Cu 중심이 4개의 산소 원자에 둘러싸인 평면 사각형 구조를 가지며, 응축시키면 중합한다.[26]
2. 2. 수화 질산 구리(II)
질산으로 구리 금속 또는 그 산화물을 처리하여 수화 질산 구리를 제조한다.[1]: Cu + 4 HNO3 → Cu(NO3)2 + 2 H2O + 2 NO2
구리 금속을 질산은의 수용액으로 처리하여 같은 염을 제조할 수도 있다. 이 반응은 구리 금속이 은 이온을 환원하는 능력을 보여준다.
수용액에서 수화물은 아쿠아 착물 [Cu(H2O)6]2+로 존재한다. 이러한 착물은 구리(II)의 d9 전자 배열로 인해 매우 불안정하며 빠른 리간드 교환이 일어난다.
가열하여 수화 질산 구리(II)의 탈수를 시도하면 Cu(NO3)2가 아닌 산화물을 얻는다.[4] 80 °C에서 수화물은 "염기성 질산 구리"인 Cu2(NO3)(OH)3로 변환되고, 180 °C에서 CuO로 변환된다.[16] 이러한 반응성을 이용하여 질산 구리는 분해될 때까지 가열하고 연기를 물로 직접 통과시켜 질산을 생성하는 데 사용할 수 있다. 이 방법은 오스트발트 공정의 마지막 단계와 유사하다. 방정식은 다음과 같다.
: 2 Cu(NO3)2 → 2 CuO + 4 NO2 + O2
: 3 NO2 + H2O → 2 HNO3 + NO
질산 구리(II) 용액을 트리페닐포스핀, 트리페닐아르신, 트리페닐스티빈으로 처리하면 해당 구리(I) 착물 [Cu(EPh3)3]NO3 (E = P, As, Sb; Ph = C6H5)가 생성된다. 그룹 V 리간드는 산화물로 산화된다.[5]
다음과 같은 다섯 가지 수화물이 보고되었다.
- 일수화물(Cu(NO3)2·2H2O)[8]
- 세스키수화물(Cu(NO3)2·1.5H2O)[12]
- 반오수화물(Cu(NO3)2·2.5H2O)[13]
- 삼수화물(Cu(NO3)2·3H2O)[14]
- 육수화물([Cu(OH2)6](NO3)2)[15]
육수화물의 결정 구조는 6개의 거의 동일한 Cu-O 거리를 나타내며, 그렇지 않으면 팔면체 Cu(II) 착체의 특징인 일반적인 야-텔러 효과를 나타내지 않는 것으로 보였다. 이러한 비효과는 Cu-O 결합의 탄성을 제한하는 강한 수소 결합 때문이라고 여겨졌지만, 아마도 정련 과정에서 니켈이 구리로 잘못 식별되었기 때문일 것이다.
Cu(NO3)2(H2O)2.5는 Cu 중심이 물과 질산 이온에 둘러싸인 정팔면체 구조를 갖는다.[26] 이 수화물은 약 170℃에서 산화 구리(II), 이산화 질소, 산소로 분해된다.
: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
3. 합성 및 반응
질산 구리(II)는 다양한 방법으로 합성될 수 있다. 수화 질산 구리(II)는 무수 상태 물질을 물에 녹이거나, 금속 구리를 질산 또는 질산 은 수용액과 반응시켜 만들 수 있다.
: Cu + 4 HNO3 → Cu(NO3)2 + 2 H2O + 2 NO2
무수 질산 구리(II)는 금속 구리와 사산화 이질소를 반응시켜 얻는다.
: Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
질산 구리(II)를 가열하여 생성되는 기체를 물에 통과시키면 질산을 얻을 수 있는데, 이는 오스트발트법의 마지막 단계와 유사하다.[28]
: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
: 3NO2 + H2O → 2HNO3 + NO
3. 1. 수화 질산 구리(II) 합성
수화된 질산 구리(II)는 무수 상태 물질의 수화, 농축된 질산 또는 질산 은 수용액과 금속 구리를 이용해서 만들 수 있다.질산으로 구리 금속 또는 그 산화물을 처리하여 수화 질산 구리(II)를 제조한다.[16]
구리 금속을 질산은의 수용액으로 처리하여 같은 염을 제조할 수도 있다. 이 반응은 구리 금속이 은 이온을 환원하는 능력을 보여준다.
수용액에서 수화물은 아쿠아 착물 형태로 존재한다. 이러한 착물은 구리(II)의 d9 전자 배치로 인해 매우 불안정하며 빠른 리간드 교환이 일어난다.
3. 2. 무수 질산 구리(II) 합성
금속 구리를 사산화 이질소로 처리하여 무수 질산 구리(II)를 얻을 수 있다.[28]:Cu + 2 N2O4 → Cu(NO3)2 + 2 NO
무수 질산 구리(II)는 몇 안 되는 무수 전이 금속 질산염 중 하나이다.[6] 물을 포함하거나 생성하는 반응으로는 제조할 수 없다.[4]
3. 3. 질산 생성 (오스트발트법 유사)
질산 구리(II)를 가열하여 발생한 기체를 물에 통과시켜 질산을 생성한다. 이는 오스트발트법의 최종 단계와 유사하다.[28]:
:
4. 이용
질산 구리(II)는 다양한 용도로 사용된다. 산화 구리(II)를 얻어 촉매로 사용하거나, 직물 및 금속 연마에 쓰인다. 일부 폭죽 제조나 학교에서 볼타 전지 반응 실험에도 사용되며, 세라믹 유약 및 금속 녹청의 구성 요소이기도 하다.[16]
4. 1. 촉매
유기화학에서 주로 쓰이는 촉매인 산화 구리(II)를 얻기 위해 사용된다.[16]4. 2. 금속 처리
질산 구리(II) 수용액은 직물이나 금속의 연마에 쓰인다.[16]4. 3. 기타
질산 구리(II)는 일부 폭죽에 사용되며,[16] 학교 실험실에서 볼타 전지 반응을 시연하는 데 자주 사용된다. 일부 세라믹 유약 및 금속 녹청의 구성 요소이기도 하다.4. 4. 유기 합성
질산 구리(II)는 아세트산 무수물과 함께 방향족 화합물의 니트레이션 (멘케 니트레이션)에 효과적인 시약이다.[17] 점토에 흡착된 수화 질산 구리(II)는 "클레이캅(Claycop)"이라는 시약을 제공한다. 생성된 파란색 점토는 슬러리로 사용되며, 티올을 다이설파이드로 산화시키거나 디티오아세탈을 카르보닐로 전환하는 데 사용된다.[18] 몬모릴로나이트를 기반으로 한 관련 시약도 방향족 화합물의 니트레이션에 유용한 것으로 입증되었다.[19]4. 5. 전해 채취
질산 구리(II)는 소규모 구리 전해 채취에 사용될 수 있으며, 부산물로 암모니아(NH3)가 생성된다.[20]5. 천연 존재
이상적인 Cu(NO3)2 화학식이나 수화물 형태의 광물은 알려져 있지 않다. 리카사이트(Cu3(NO3)(OH)5·2H2O)와 버트겐바키사이트(Cu19(NO3)2(OH)32Cl4·2H2O)는 관련 광물이다.[21][25]
자연적으로 발생하는 염기성 질산 구리에는 희귀 광물인 게르하르트광과 루아이트가 포함되며, 둘 다 Cu2(NO3)(OH)3의 동질이상체이다.[22][23][24] 훨씬 더 복잡하고 염기성이며 수화되고 염화물을 함유한 자연 염은 버트겐바키사이트이다.[25][24]
참조
[1]
서적
Perrys' Chem Eng Handbook, 7th Ed
[2]
간행물
PGCH
[3]
서적
Practical Inorganic Chemistry
Chapman and Hall
[4]
서적
Greenwood&Earnshaw2nd
[5]
서적
Inorganic Syntheses
[6]
논문
Structural Aspects of Co-ordinated Nitrate Groups
[7]
논문
526. The crystal structures of anhydrous nitrates and their complexes. Part I. The α form of copper(II) nitrate
[8]
논문
Synthesis and X-Ray Structure of New Copper(II) Nitrates: Cu(NO3)2·H2O and β-modification of Cu(NO3)2
[9]
논문
The crystal structure of anhydrous nitrates and their complexes. II. The 1:1 copper(II) nitrate-nitromethane complex
[10]
논문
628. The vapour pressure of anhydrous copper nitrate, and its molecular weight in the vapour state
[11]
논문
The Structure of Gaseous Copper(II) Nitrate as Determined by Electron Diffraction
[12]
논문
Zur Struktur des Kupfernitrates Cu(NO3)2.1.5H2O
[13]
논문
The crystal structure of Cu(NO3)2.2.5H2O
[14]
논문
Sbornik Prac. Chem.-Technol. Fak. Svst., Cskosl.
[15]
논문
Hexaaquacopper(II) dinitrate: absence of Jahn-Teller distortion
[16]
간행물
Copper Compounds
Wiley-VCH, Weinheim
[17]
논문
Nitration with nitrates
[18]
간행물
Copper(II) Nitrate–K10 Bentonite Clay
J. Wiley & Sons, New York
[19]
논문
Clays Direct Aromatic Nitration
[20]
웹사이트
Influence of ammonium salt on electrowinning of copper from ammoniacal alkaline solutions
https://linkinghub.e[...]
2007-11-01
[21]
웹사이트
Likasite
https://www.mindat.o[...]
[22]
웹사이트
Gerhardtite
https://www.mindat.o[...]
[23]
웹사이트
Rouaite
https://www.mindat.o[...]
[24]
웹사이트
List of Minerals
https://www.ima-mine[...]
2011-03-21
[25]
웹사이트
Buttgenbachite
https://www.mindat.o[...]
[26]
서적
Structural Inorganic Chemistry
Oxford: Clarendon Press
[27]
문서
転送
[28]
서적
The Synthesis and Characterization of Inorganic Compounds
Prentice Hall, London
[29]
서적
Perrys' Chem Eng Handbook, 7th Ed
[30]
간행물
PGCH
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com